Sauerstoff
Der Sauerstoffgehalt des Wassers sollte möglichst hoch, d. h. nahe am Sättigungswert sein. Ein hoher Sättigungsgehalt ist eine der wichtigsten Voraussetzungen für gesundes Wachstum. Sauerstoffmangel führt zu verminderter Nahrungsaufnahme bis hin zur Verweigerung jeglicher Nahrung. Die Fische sind dann geschwächt, erkranken häufiger als andere und werden bevorzugt von Parasiten befallen. Chronischer Sauerstoffmangel kann somit zu einem schleichenden Sterben führen, das leider häufig wegen des Auftretens sekundärer Erkrankungen auf andere Ursachen zurückgeführt wird.
Sauerstoffgehalt
Der Sauerstoffgehalt eines Fließgewässers ist ein Maß für die Selbstreinigungskraft der Gewässer. Er ist abhängig von der Wassertemperatur. So ist das Wasser an Sauerstoff gesättigt (100 %), wenn es z. B. 10 mg Sauerstoff/Liter enthält bei einer Wassertemperatur von 14 °C. Ein Teil des Sauerstoffes wird für den Abbau der Verschmutzung gebraucht. Je größer die Verschmutzung, umso kleiner wird der Sauerstoffgehalt im Wasser. Wenn der Sauerstoffgehalt unter 2 - 3 mg/l sinkt, wird das Fischleben im Gewässer gefährdet. Der Sauerstoffeintrag in ein Gewässer erfolgt durch Diffusion aus der Luft, wobei Wind und Wellenbewegung eine wichtige Rolle spielen, sowie bei Tageslicht durch lebende Pflanzen und Algen. Weitere wichtige Faktoren für den Sauerstoffeintrag in Gewässer sind die seichten Stellen im Uferbereich.
Biochemischer Sauerstoffbedarf in 5 Tagen (BSB5) mg/l
Der BSB ist die Menge Sauerstoff in mg/l, die von Mikroorganismen verbraucht wird, um im Wasser vorhandene organische Stoffe oxidativ abzubauen. Üblicherweise beendet man die Messung nach 5 Tagen und misst bei 20 °C (BSB5). Die Mikroorganismen bevorzugen gewisse Stoffe und Stoffgruppen (leicht abbaubare Stoffe), so dass nie die Summe der organischen Belastung eines Wassers mit dieser Bestimmungsmethode erfasst wird. Der BSB5 lässt sich durch vollbiologische Reinigung zu 90 % und mehr aus dem Abwasser entfernen.
Der biologische Sauerstoffbedarf drückt die Sauerstoffzehrung eines Gewässers aus. Am folgereichsten sind die Auswirkungen der fäulnisfähigen organischen Stoffe häuslicher und gewerblich-industrieller Abwässer auf den Sauerstoffhaushalt. Nur selten sind andere chemische Abwasserinhaltsstoffe, z. B. Eisen-II-Verbindungen, Sulfite und Sulfide, für die Sauerstoffzehrung verantwortlich.
Der Gehalt an gelöstem Sauerstoff kann im Tages- und Jahresablauf - in Abhängigkeit von Schwankungen der Temperatur, der Photosynthese sowie Atmung von Wasserorganismen und zugleich der Abwasserlast - starken Änderungen unterworfen sein.
Der Sauerstoffverbrauch von Fischen wird von der Temperatur bestimmt. Bei steigender Temperatur verbrauchen sie immer mehr Sauerstoff und man kann als Faustregel angeben, dass eine Temperaturerhöhung von 10 °C den Grundumsatz um das 2 - 3fache erhöht. Dies entspricht mindestens dem doppelten Sauerstoffverbrauch. Er kann aber auch wesentlich höher liegen. Wird in ein Fischwasser Kühlwasser aus Kraftwerken eingeleitet, steigt durch die erhöhte Temperatur der Sauerstoffverbrauch der Fische, das Sauerstoffangebot im Wasser wird aber immer geringer.
Man weiß z. B., dass der Sauerstoffverbrauch von Renkeneiern bei 10 °C etwa 30-mal höher ist als bei 0 °C. Darum können sich die Eier auch nur dort entwickeln, wo ein der Wassertemperatur entsprechend hoher Sauerstoffgehalt vorhanden ist.
Den Zusammenhang zwischen der Verschmutzung des Gewässers und der Abbautätigkeit der Mikroorganismen nutzt man aus, um durch ein ganz einfaches Verfahren zuverlässige Werte über den Verschmutzungsgrad eines Wassers zu erhalten. Wird dem entnommenen Probewasser durch die Bakterientätigkeit viel Sauerstoff entzogen, muss die Belastung groß gewesen sein. Ist der Sauerstoffverbrauch dagegen sehr gering, so war auch nur wenig abbaubare Substanz im Wasser enthalten. Man braucht also nur den Sauerstoffverbrauch innerhalb einer bestimmten Zeit zu messen und schon hat man Aussagen über die organische Belastung.
Hohe organische Belastung kann zu einer übermäßigen Sauerstoffzehrung führen und damit Fischsterben hervorrufen.
Ist der Sauerstoffbedarf größer als die Sauerstoffaufnahme aus der Luft oder die Sauerstoffproduktion von Wasserpflanzen, so tritt ein Sauerstoffdefizit ein.
pH-Wert
Definition: Ob Wasser neutral, sauer oder basisch ist wird durch den pH-Wert ausgedrückt; bei pH 7 ist das Wasser neutral; pH-Werte von 7 an abwärts signalisieren zunehmend saures Wasser, von pH 7 an aufwärts zunehmend alkalisches. Innerhalb eines bestimmten Bereiches können Fische und andere Wassertiere schwache Säuren und Laugen tolerieren.
Als ideal ist der Bereich zwischen pH 7 und pH 8 - 8,5 einzustufen. pH-Werte unter und über diesem Bereich können Haut- und Kiemenschäden hervorrufen.
Eine pH-Wertverschiebung in den basischen Bereich erhöht den Ammoniakgehalt.
Der pH-Wert wird mit steigenden Säurebindungswerten stabiler. Kalk bindet die Säuren, puffert und stabilisiert damit den pH-Wert.
Säurebindungsvermögen (SBV)
In der Fischerei wird der Härtegrad als linear transformierter Wert - dem Säurebindungsvermögen - angegeben. Je höher das SBV, desto mehr Kalk ist im Wasser gelöst.
Das Säurebindungsvermögen sagt nicht nur etwas über den Kalkgehalt eines Gewässers, sondern auch über dessen Fruchtbarkeit aus.
Bei Werten zwischen 0,5 und 2 können wir mit guten Fischerträgen rechnen. Bei Werten zwischen 2 und 5 sogar mit sehr guten.
Liegt der SBV-Wert noch darüber, können maximale Erträge erreicht werden.
In den meisten Gewässern ist der SBV-Wert jedoch durch Abwässer gegenüber dem natürlichen SBV erhöht.
Ammonium und Ammoniak
Ammonium und Ammoniak gelangen vor allem durch das Abwasser der Haushalte in die Flüsse. Ammonium ist weit weniger giftig als Ammoniak. Dabei ist der pH-Wert zu beachten. Bei einem pH-Wert von 5 liegt zu 100 % Ammonium vor, bei einem pH-Wert von 10 liegt zu 80 % das wesentlich giftigere Ammoniak vor. Dadurch ist es möglich, dass durch eine pH-Wert-Änderung ein Fischsterben ausgelöst wird. Die Giftigkeit der beiden Stoffe ist außerdem temperaturabhängig. Bei 25 °C ist Ammonium bzw. Ammoniak viermal so giftig wie bei 5 °C.
Extrem hohe Werte, die bei manchen Abwassereinleitungen anzutreffen sind, klingen durch die Selbstreinigungskraft des Flusses allmählich ab. Dabei wird Ammonium unter Sauerstoffverbrauch zu Nitrat umgewandelt.
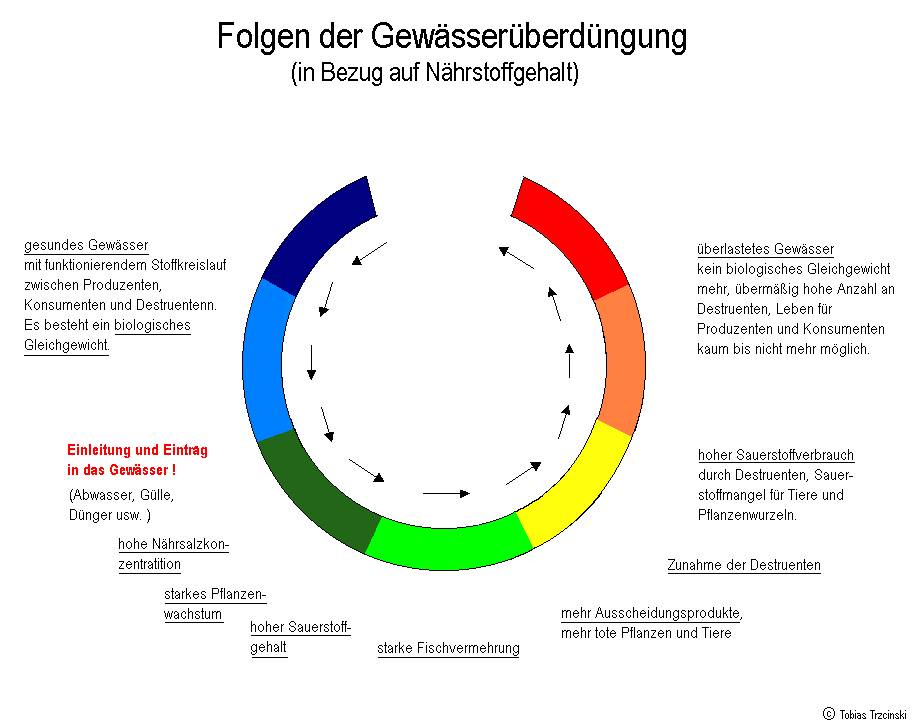
Nitrat und Nitrit
Nitrat ist ein natürliches Nährsalz, welches Pflanzen zum Wachstum benötigen. Es entsteht durch die Oxidation des Ammoniums/Ammoniaks, gelangt aber auch durch die Überdüngung von Feldern in naheliegende Gewässer. Nach der Düngung ist der Autoverkehr die zweite Quelle für Nitrat im Boden.
Steigt der Nitratgehalt übermäßig an, kommt es zu enormem Wachstum aller Pflanzen, die das Wasser dann stark belasten (siehe Grafik).
Bei Sauerstoffmangel im Wasser kann aus Nitrat Nitrit entstehen. Nitrit ist ein gefährliches Fischgift.
Phosphat
Phosphate sind gut lösliche Phosphorverbindungen. Sie sind ungiftig, haben aber eine hohe Düngewirkung, was eine Eutrophierung zur Folge hat. Sie werden über häusliche Abwässer (phosphathaltige Waschmittel) und durch Dünger aus der Landwirtschaft in Gewässer eingetragen.